임상 SAE 보고 및 관리 간소화
Safety-EDC Connection을 통해 중대한 이상사례(SAE)를 포함하여 보고된 이상사례에 대한 포괄적인 정보를 자동으로 교환하고, 데이터 관리팀과 약물감시팀 간의 조정을 간소화합니다. 관련 피험자 데이터를 포함하여 200개 이상의 케이스북 및 사용자 정의 데이터 필드(E2B보다 100% 더 많음)에서 정보를 선택하고 전송할 수 있는 유연성이 있습니다. 적용 가능한 정보를 쉽게 공유하면 임상 시험 기관에 대한 쿼리가 줄어들고 약물감시팀이 케이스를 보다 신속하게 처리하고 안전성 결과물의 품질을 개선할 수 있습니다.
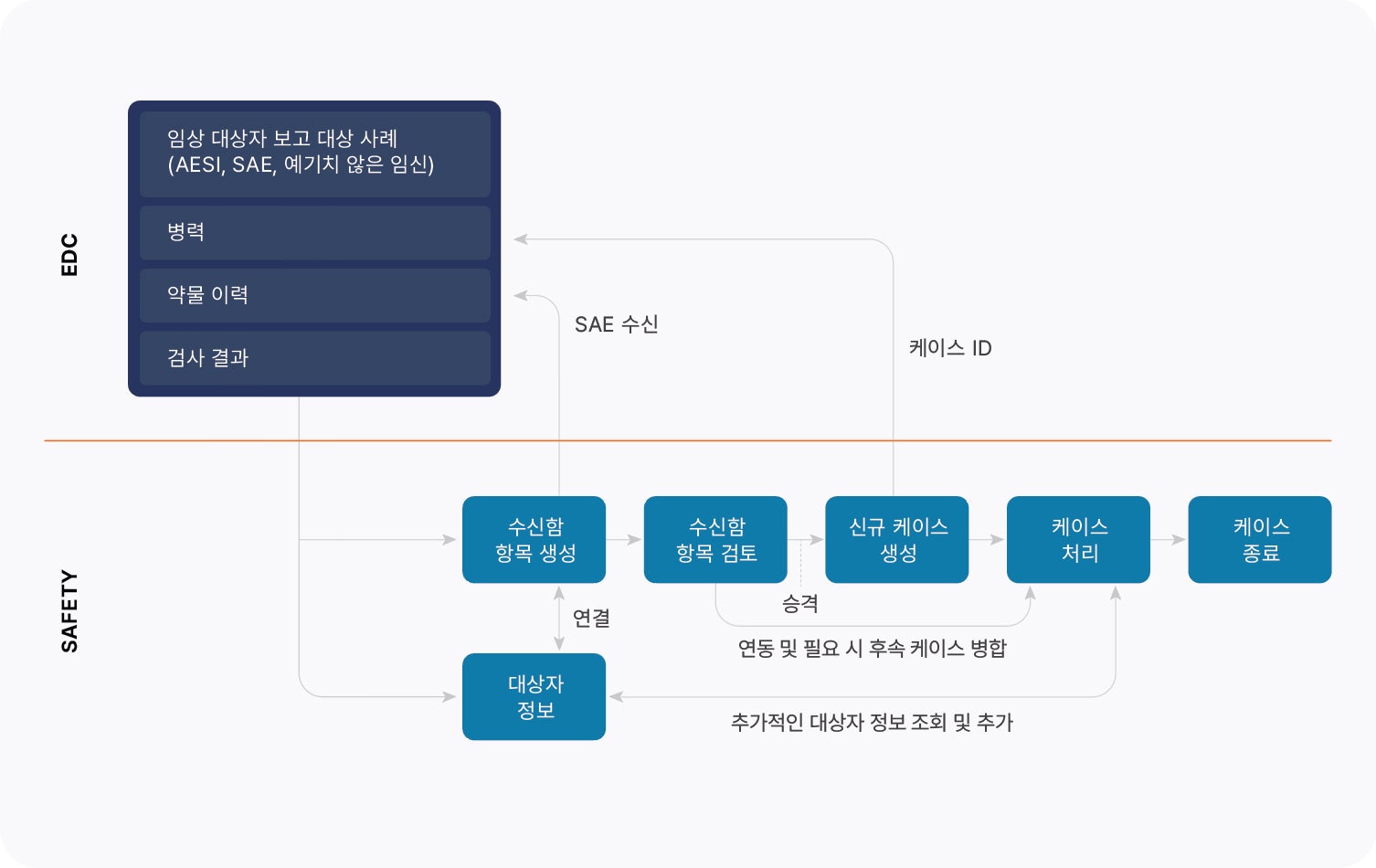
임상 및 데이터팀은 이상사례가 Veeva Safety의 사례로 승격되는 경우 SAE 접수 및 케이스 ID를 확인할 수 있습니다. 시험 기관에서 SAE를 변경하면 새 데이터가 자동으로 Veeva Safety로 전송되고 후속 조치로 연결됩니다. 후속 조치는 진행 중인 케이스에 대한 신속한 처리를 보장하기 위해 ‘중요’로 표시될 수도 있습니다. SAE 및 케이스 후속 조치를 임상 원본 데이터에 다시 연결하면 데이터 불일치 및 케이스 처리 검토 시간의 위험을 줄이고 조정 프로세스를 간소화할 수 있습니다.
특장점
Veeva의 특화된 Safety-EDC Connection은 Veeva EDC와 Veeva Safety 간의 데이터 공유를 자동화합니다.
약물감시팀
- 포괄적인 데이터 수집 자동화:
200개 이상의 임상시험 대상자 보고 가능한 이벤트 데이터 필드 전송
- 케이스 처리 가속화:
관련 대상자 데이터 보기 및 추가
- 안전성 결과 개선:
전체 대상자 정보와 함께 SAE(이상사례) 조회
- 조정 간소화:
SAE, 시험 대상자 데이터 및 후속 조치는 임상 데이터 소스와 연동
임상 및 데이터팀
- 수동 조정을 크게 줄임:
자동화된 데이터 흐름을 통해 EDC와 Safety 애플리케이션 간의 데이터 일관성 유지
- 시험기관 부담 감소:
PV(약물 감시)팀은 관련 대상자 데이터에 독립적으로 접근 및 추가하여 시험기관 및 임상 팀의 쿼리 감소
- 효율적인 커뮤니케이션:
SAE 접수 및 안전성 케이스 ID에 대한 가시성 확보
Safety-EDC Connection 작동 방식
임상 시험 기관에서 Veeva EDC에 SAE를 입력하면, Safety-EDC Connection은 Veeva Safety에 수신함 항목을 자동으로 생성하고 관련 피험자 데이터를 전송합니다. 케이스 처리 담당자는 새로운 안전성 수신함 항목을 검토하고, 기준을 충족하는 경우 SAE를 초기 케이스로 승격시키고 Veeva Safety 케이스 ID를 Veeva EDC와 공유합니다. Veeva Safety에서 케이스를 처리하는 동안 의학 검토자가 추가 데이터가 필요한 경우 Veeva EDC에서 병력 및 투약 기록, 검사 결과 및 기타 이상 반응과 같은 추가적인 피험자 정보를 확인하고 포함시킬 수 있습니다. 시험기관 사용자가 나중에 Veeva EDC에서 SAE를 업데이트하면, Safety-EDC Connection이 새로운 후속 조치 수신함 항목을 자동으로 생성하고, 이를 약물감시 케이스에 연결하며, 사전 정의된 기준에 따라 중요한 항목으로 플래그를 지정할 수 있습니다. 케이스 처리 담당자는 후속 데이터를 검토하고 선택적으로 기존 케이스와 병합할 수 있습니다.
Veeva EDC와 Veeva Safety 간의 데이터 동기화는 맵핑된 데이터 필드를 통해 관리 및 유지됩니다. 조직은 기본 필드를 쉽게 추가, 수정 또는 비활성화하여 설정 및 구성을 간소화할 수 있습니다.
Safety-EDC Connection demo에 대한 자세한 내용은 Veeva 팀에게 문의하십시오.
