제품 개발을 위한 기술 기반
Veeva Development Cloud는 임상, 허가, 그리고 약물감시 분야의 애플리케이션을 통합하여 조직이 포괄적인 비즈니스 프로세스를 추진하도록 돕는 제품 개발을 위한 기술 기반입니다. 오늘날 제품 개발 시스템들은 잘 연동되지 않아 비효율을 초래하고 핵심 운영 속도를 저하시킵니다. Veeva는 단일 클라우드 플랫폼에서 연결된 통합 애플리케이션 제품군을 제공하는 최초이자 유일한 기업입니다. 이를 통해 조직은 글로벌 부서 전반의 컨텐츠와 데이터를 중앙 집중화하여 더 높은 효율성과 컴플라이언스를 달성합니다.
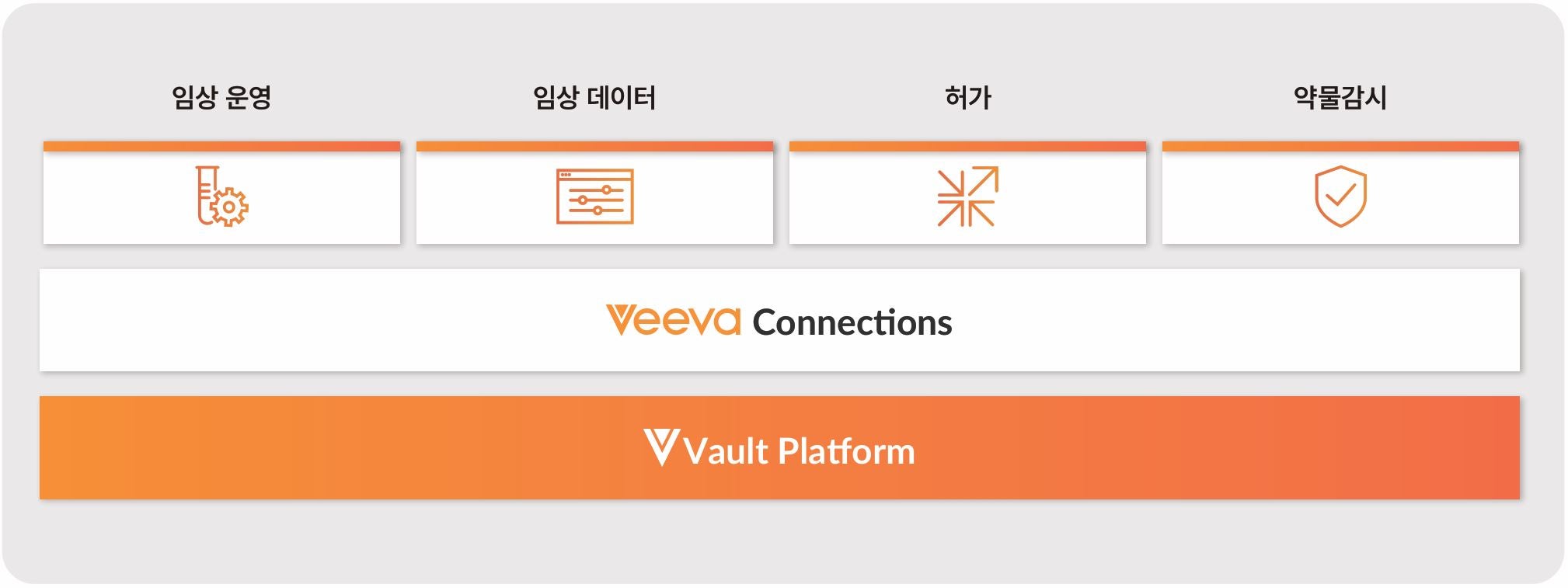
Veeva Connections
Veeva Connections는 임상, 허가, 약물감시 Vault 간에 데이터와 문서를 원활하게 전송하는 연동 기능입니다. 부서 간 비즈니스 프로세스를 간소화하도록 설계된 이 Connections 기능들은 사일로를 해소하고 더 높은 가시성을 제공하며 수작업을 자동화합니다. 이용 가능한 모든 Veeva Connections 기능 목록은 Veeva Connections Resource Hub를 참조하십시오.
Veeva Clinical Operations
임상시험 실행을 단순화하고 표준화합니다.
Veeva Clinical Operations는 단일 클라우드 플랫폼에서 임상 시스템 및 프로세스를 통합하여 포괄적인 임상시험 관리를 지원합니다.
- Veeva eTMF – 활성 eTMF를 통해 실시간 실사 준비 상태를 확보합니다.
- Veeva CTMS – 선제적인 임상시험 관리를 지원합니다.
- Veeva Payments – 시험기관에 더 신속하게 연구비를 지급합니다.
- Veeva Study Startup – 시험기관 활성화 기간을 가속화합니다.
- Veeva RTSM – 대상자를 무작위로 배정하고 임상시험 제품 공급을 관리합니다.
- Veeva Site Connect – 정보 공유를 자동화합니다.
- Veeva Study Training – 교육을 간소화하고 자동화합니다.
- Veeva Disclosures – 임상시험 디스클로저를 중앙 집중화합니다.
- Veeva OpenData Clinical – 조사관 및 시험기관 데이터를 제공합니다.
Veeva Clinical Data
현대적이고 혁신적인 임상 데이터 애플리케이션으로 연구 일정을 가속화합니다.
Veeva Clinical Data는 임상팀이 민첩하고 빠르게 임상시험 데이터를 수집, 통합, 정제 및 관리하도록 지원합니다.
- Veeva EDC – 연구 데이터를 수집, 정제 및 검토합니다.
- Veeva CDB – 완전하고 동시적인 스터디 데이터를 관리합니다.
- Veeva eCOA – 임상시험 참여자로부터 응답을 직접 수집합니다.
Veeva RIM
통합된 RIM으로 허가 팀에 속도와 민첩성을 더합니다.
허가 시스템과 프로세스를 단일 클라우드 플랫폼에 통합하여 포괄적인 제출 및 등록 관리를 구현합니다.
- Veeva Registrations – 전 세계 등록을 추적합니다.
- Veeva Submissions – 제출을 계획하고 관리합니다.
- Veeva Submissions Publishing – 보건 당국에 제출 문서를 발행합니다.
- Veeva Submissions Archive – 제출 이력에 대한 접근성을 제공합니다.
Veeva Safety
Safety 애플리케이션들은 단일 클라우드 플랫폼에서 통합된 약물감시 시스템으로서 운영 효율성을 극대화하고 환자 안전을 개선합니다.
- Veeva Safety – 이상 사례를 실시간으로 관리 및 감독합니다.
- Veeva SafetyDocs – 약물감시 프로세스와 컨텐츠를 중앙 집중식으로 관리합니다.
- Veeva Safety Workbench – 고급 보고서, 질의 및 분석 실행을 지원합니다.
- Veeva Safety Signal – 잠재적인 안전성 시그널을 신뢰할 수 있게 감지하고, 유효성을 검증하며 관리합니다.
To learn more, watch this 13 minute demo of the Veeva Development Cloud in action.
