Veeva Submissions Publishing
継続的なパブリッシングで薬事申請を劇的にスピードアップ
Submissions Publishing は、世界の規制当局向けの電子申請書類を生成します。Veeva は、規制の変化に対応するための新たなテンプレートとバリデーション基準をリリースします。Submissions Publishing は、ライフサイクルの初期に作成したコンテンツ計画を活用して、個別文書の最終化後すぐにパブリッシングプロセスを開始することができます。
ユーザーは、テキスト内で内部および外部の参照文献へのハイパーリンクを作成できます。許可されている市場では、Vault から規制当局に直接申請書類をパブリッシュできます。
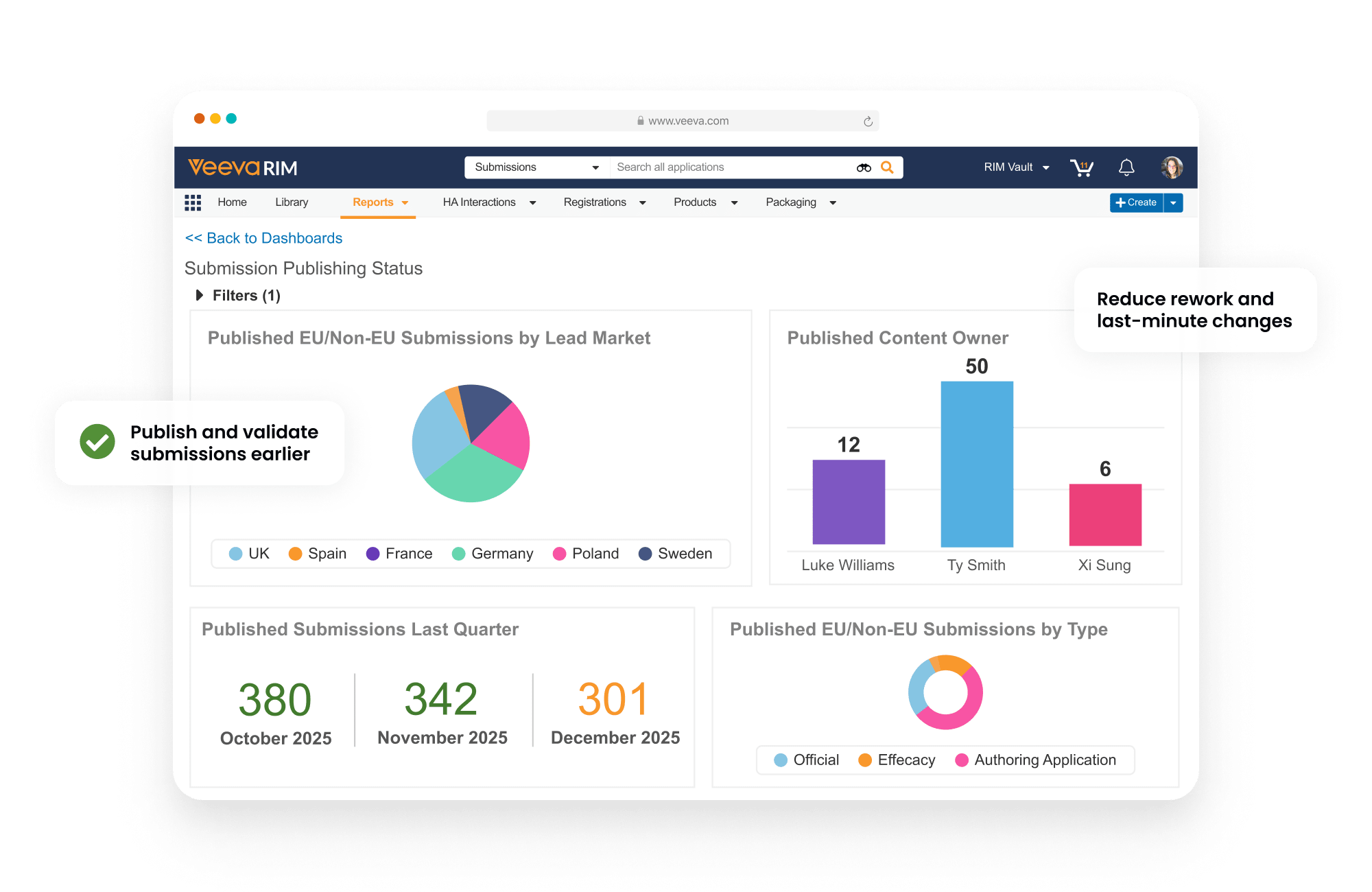
申請者は、ダッシュボードとレポートを使用して、申請書類の各コンポーネントの作成から完成までの進捗を追跡することができます。
Announced 2017 Status Mature Customers 51-100
Impact
時間短縮・手間の軽減
50%
申請書類の作成時間を短縮
5週間
NDA(新薬承認申請)のタイムラインを短縮
700時間
ゲートウェイからの直接申請による節減時間
Why Veeva Submissions Publishing
作業のやり直しと遅延を軽減
Customer Success
Veeva RIM は 400 社以上の主要製薬企業
およびバイオ医薬品企業に選ばれています















